众所周知,专利带来的市场独占期的长短往往涉及巨大的经济利益,特别是在医药领域。为鼓励行业创新发展,部分国家设置了专利期限补偿制度,以补偿过长的专利审查过程或药品上市许可审批过程导致的权利损失。前者的先例如美国的专利期调整制度(“PTA”,35 U.S.C §154)、韩国的注册延迟后的专利期补偿制度(专利法案92-2),后者的先例如美国的专利期延长制度(“PTE”,35 U.S.C §156)、欧洲经济区(EEA)内的补充保护证书制度(“SPC”,Regulation (EC) No. 469/2009)。
第四次修改后的《中华人民共和国专利法》第四十二条第二、三款第一次为中国引入了专利权期限补偿制度。该法律修改已于2021年6月1日起生效施行。近日出台并将于2024年1月20日起施行的《专利法实施细则》和《专利审查指南》为这一制度做了细化规定。本文将对此制度的具体规则作一介绍。
根据专利法第四十二条第二、三款,中国的专利权期限补偿分为:因发明专利授权过程中的不合理延迟给予的补偿(第四十二条第二款,以下简称PTA),以及因新药上市审评审批占用时间给予的补偿(第四十二条第三款,以下简称PTE)两种。
Part I PTA
1. 适用范围
符合补偿条件的授权发明专利均可以适用PTA。仅有一条排除条件:若发明专利属于同日对同样的发明创造既申请实用新型专利又申请发明专利的(即“同日双申”),则此发明专利不适用PTA。
2. 申请时间
专利权人应当在授权公告日后3个月内向国家知识产权局提出请求。委托代理机构的,应当通过代理机构办理。
对专利法修改生效到实施细则生效之间的过渡时期(即2021年6月1日至2024年1月20日)而言:在2021年6月1日后授权的发明专利,如果在授权公告后3个月内提出了申请,经审查可以适用PTA。这一审查将在2024年1月20日《实施细则》施行后进行。如果在此期间专利权已经届满,但后续经审查符合补偿条件的,也给予期限补偿,并从原届满之日起起算补偿期。
3. 补偿期计算
PTA补偿期按照此公式计算:
补偿期限=授权过程中不合理延迟-合理延迟-申请人引起的不合理延迟
a) 授权过程中不合理延迟
不合理延迟是指授权日与申请日、实审请求日相比过于滞后的情形。具体的计算方法为:自申请日起满四年且自实审请求日起满三年的日期至授权日之间的时间。当公布日晚于实审请求日时,以公布日起算。总之,不合理延迟为申请日+4年、实审请求日+3年和公布日+3年这三个日期中最后者到授权日之间的时间。
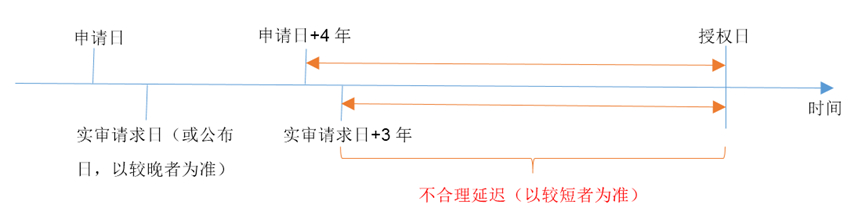
对于PCT申请与分案申请,申请日需分别以进入中国国家阶段日和分案申请提交日为准计算。
b) 合理延迟
以上不合理延迟D中属于合理延迟的部分需在补偿期中扣除,包括:
- 存在复审程序,其中申请人在提出复审请求或答复复审通知时对申请文件作出了修改的;
- 因专利申请权权属纠纷,审查程序中止的;
- 法院裁定对专利申请权采取保全措施的;
- 其他合理延迟,如行政诉讼程序。
c) 申请人引起的不合理延迟
不合理延迟中属于申请人引起的部分也需在补偿期中扣除,包括:
- 未在指定期限内答复通知的;
- 申请延迟审查的;
- 援引加入;
- 请求过权利恢复的;
- PCT申请进入国家阶段时,未要求提前处理的(下文详述)。
如上文所述,对于PCT申请,在不合理延迟D的计算中,申请日需以进入中国国家阶段日为准。但根据PCT条约第23条,除非申请人明确请求,指定局不应在优先权日(PRI)起30个月的期限届满前进行处理。也就是说,如果申请人在优先权日30没有要求提前处理,那么在进入国家阶段到优先权日后30个月届满之间的这段时间,国家知识产权局不会处理这一申请。按上述规定,这段时间需要在补偿期中扣除。

根据国家知识产权局公布的数据,目前中国发明专利的平均审查时间已缩短至16个月。由于适用PTA至少需要审查周期大于4年。因此从专利领域整体上看,PTA的适用面有限。
就医药领域而言,笔者对2023年第四季度获得授权的化学医药领域专利(仅根据国际分类号A61K OR A61P OR C07做了初筛)作了简单统计。在9,871件授权专利中,平均授权周期为882天,授权周期超过4年的共1,773件(18.0%)。可见由于医药领域专利审查较为复杂,流程普遍更加延宕,PTA在加强药品相关专利保护、鼓励医药产业创新方面应可以起到一定的积极作用。
4. 审查和救济程序
PTA的审查应当满足听证原则,在作出不予补偿的决定前,应当至少给予请求人一次陈述意见/补正文件的机会。作出补偿决定后,相关事项将在专利登记簿上登记,并在专利公报上公告。
当对决定内容存在争议时,专利权人或存在专利侵权纠纷的第三方可以向国家知识产权局申请行政复议。规定中并未写明起诉前必须先行复议,因此理论上不排除直接向法院起诉的可行性。
Part II PTE
1. 适用范围
PTE适用于经药监部门批准上市的创新药和符合规定的改良型新药的相关专利。
其中,请求PTE的专利应当属于产品发明专利、制备方法发明专利或医药用途发明专利。
按《审查指南》规定,创新药的含义“依照有关法律法规并按照国务院药品监督管理部门的相关规定确定”。此处的“相关规定”可以理解为药监部门发布的中国药品注册分类标准,按中药(天然药物)、化学药品和生物制品三大类各自规定了细分标准。若作此理解,结合《审查指南》中对“符合规定的改良型新药”的规定,我们将可以适用PTE的药品类别梳理如下(标红为适用PTE的):


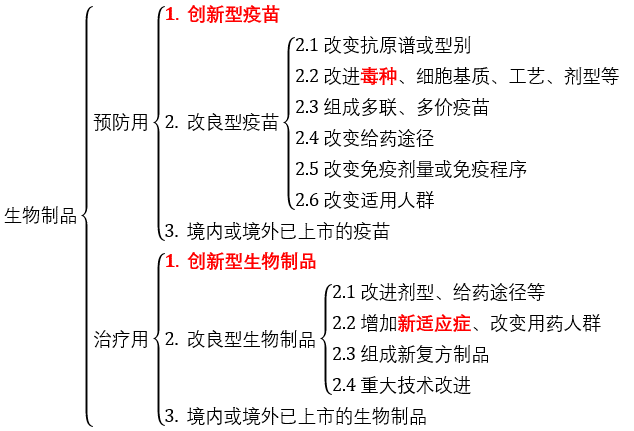
值得注意的是,若按照上述规定,原研药品已在中国境外获批上市,然后作为境外已上市的药品申请中国上市的,将不被认为属于“创新药”,从而无法适用PTE。而对于改良型化药而言,仅已知药物成盐、成酯类型或针对新适应症的制剂类型的改良方可适用PTE;而对已知药物进行手性拆分,或改进剂型、处方工艺、给药途径的药品也不能适用PTE。
请求PTE的专利还应满足:
- 请求补偿的专利的授权公告日早于药品上市申请获批日;
- 请求补偿的专利处于有效状态;
- 请求补偿的专利未获得过PTE;
- 请求补偿的专利的权利要求包括了获得上市许可的新药相关技术方案;
- 同一药品存在多个专利的,仅能请求对其中一项专利给予PTE;
- 同一专利涉及多个药品的,只能就其中一个药品请求PTE。
2. 申请时间
专利权人应当在获得上市许可后3个月内向国家知识产权局请求PTE。当专利权人与药品上市许可持有人不一致时,专利权人应征得药品上市许可持有人的书面同意。对于获得附条件上市许可的药品,请求应当在获得正式上市许可后3个月内提出,但期限计算时以获得附条件上市许可的时间为准。
在PTE期间,该专利的保护范围限于此获批上市的新药、且限于该新药经批准的适应症相关的技术方案。即,不论专利的权利要求为产品、医药用途或制备方法权利要求,在PTE期间,其保护范围均受到经批准的新药产品以及经批准的适应症的限制。
对过渡时期而言:专利权人自2021年6月1日起,在新药上市许可获批3个月内提出PTE请求的,经审查可以适用PTE。也就是说,理论上2021年3月1日后获批上市的药品有机会获得PTE。其余规定同PTA相关规定(见I.2节)。
3. 补偿期计算
PTE的补偿期应当在PTA确定后计算。当PTA悬而未决或请求时限尚未届满时,应当等到PTA确定后再计算PTE,除非专利权人明确表示放弃PTA。
PTE的期限按专利申请日到新药上市获批日的时间减去5年计算,且补偿期不超过5年,从新药上市获批日到补偿后的专利权届满日之间的总有效专利权期限不超过14年。
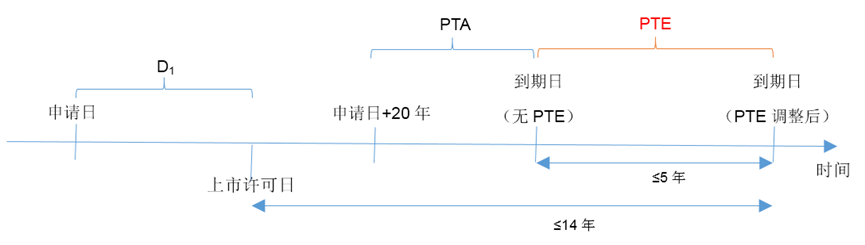
根据上述规则,笔者给出一种简明的计算方法。设从专利申请日至上市申请获批之间的时间为D1,PTA指代专利获得PTA补偿的期限。则:
- 当D1-PTA≤6年时,专利无法获得PTE;
- 当6年<D1-PTA≤11年时,PTE的期限为D1-PTA-6年;
- 当D1-PTA>11年时,PTE的期限为5年。
4. 审查和救济程序
与PTA相关规定类似(见I.4节)。唯一一处区别在于,可以申请行政复议的利益相关方除专利权人、存在专利侵权纠纷的第三方之外还可以是已经提出相关药品注册申请的第三方。
Part III 小结